Semana #7
MODELO ATÓMICO GRIEGO
Los Griegos alrededor de 500 a.C. fueron los primeros en dar la idea de la existencia de un átomo y describirlo (aunque muy diferente a lo que sabemos ahora)
Los atomistas, siendo los más destacados Demócrito y su mentor Leucipo. Desarrollaron la “teoría atómica del universo”, esta teoría afirmaba que todo lo percibido mediante los sentidos estaba formado por pequeñas partículas, invisibles,macizas, con diferentes formas y texturas, llamadas átomos.
Indicaron algunas propiedades precarias de los átomos:
-Los átomos son eternos, indivisibles, homogéneos, incompresibles e invisibles.
-Los átomos se diferencian solo en forma y tamaño, pero no por cualidades internas.
-Las propiedades de la materia varían según el agrupamiento de los átomos.
-Los átomos son eternos, indivisibles, homogéneos, incompresibles e invisibles.
-Los átomos se diferencian solo en forma y tamaño, pero no por cualidades internas.
-Las propiedades de la materia varían según el agrupamiento de los átomos.
En la antigua Grecia la palabra átomo se empleaba para referirse a la parte de la materia mas pequeña que podía concebirse. De hecho átomo significa en griego no divisible.
Este pensamiento griego no tuvo aceptación, ya que contradecía las ideas de otros filósofos como Aristóteles y Empédocles, quienes afirmaban que el origen materia estaba formada por cuatro elementos: aire, fuego, tierra y agua, que se combinaban obteniendo sustancias con distintas propiedades, negando la existencia del vacío. Aristóteles le agregó un quinto elemento: el éter, para explicar la inmutabilidad del resto del universo.


MODELO ATÓMICO DE DALTON
Para empezar, Dalton era un científico y su modelo fue el resultado de las conclusiones de varios experimentos que realizó con gases. Con base en los resultados de sus investigaciones, Dalton pudo demostrar que los átomos realmente existen, algo que Demócrito solo había inferido, creando una de las teorías más importantes en la historia de la física moderna.
Principios básicos del modelo atómico de Dalton.
- Toda la materia está hecha de átomos.
Absolutamente todo lo que conocemos está hecho de átomos tanto en la tierra como en el universo conocido. Cada uno de los elementos está hecho de átomos. - Los átomos son indivisibles e indestructibles.
Dalton pensaba que los átomos eran las partículas más pequeñas de la materia y eran químicamente indestructibles. - Todos los átomos de un elemento dado son idénticos .
Para un elemento determinado, todos sus átomos tienen la misma masa y las mismas características. - Los átomos de diferentes elementos varían en masa y propiedades.
Cada elemento tiene átomos de características y masa diferentes. - Los compuestos están formados por una combinación de dos o más tipos diferentes de átomos.
Un compuesto determinado siempre tiene los mismos tipos de átomos combinados y en las mismas proporciones. - Una reacción química es una reorganización de átomos.
Las reacciones químicas son el resultado de una separación, unión o reorganización de átomos. Sin embargo, los átomos de un elemento nunca cambian a átomos de otro elemento como resultado de una reacción química.
MODELO ATÓMICO DE NIELS BOHR
Tomando como punto de partida el modelo de Rutherford, Niels Bohr trató de incorporar en él la teoría de “cuantos de energía” desarrollada por Max Planck y el efecto fotoeléctrico observado por Albert Einstein.
En 1913, Bohr postuló la idea de que el átomo es un pequeño sistema solar con un pequeño núcleo en el centro y una nube de electrones que giran alrededor del núcleo. Hasta aquí, todo es como en el modelo Rutherford.
Lo original de la teoría de Bohr es que afirma:
A) que los electrones solamente pueden estar en órbitas fijas muy determinadas, negando todas las demás.
B) que en cada una de estas órbitas, los electrones tienen asociada una determinada energía, que es mayor en las órbitas más externas.
C) que los electrones no irradian energía al girar en torno al núcleo.
D) que el átomo emite o absorbe energía solamente cuando un electrón salta de una órbita a otra.
E) que estos saltos de órbita se producen de forma espontánea.
F) que en el salto de una órbita a otra, el electrón no pasa por ninguna órbita intermedia.

MODELO ATÓMICO DE THOMPSON
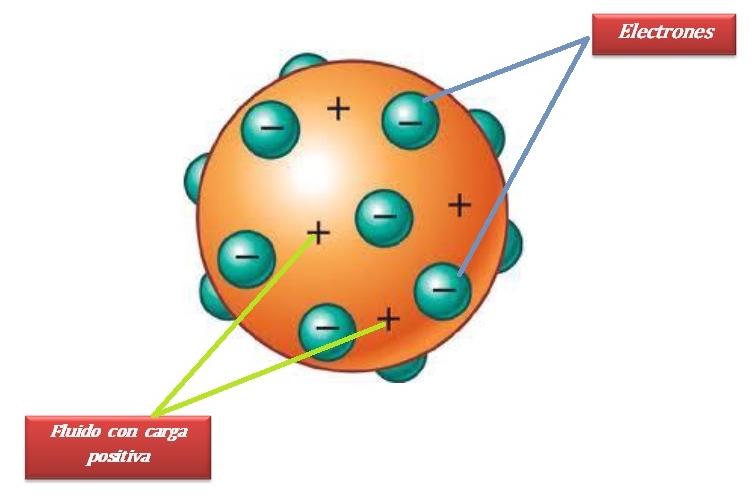
El modelo atómico de Thomson fue reconocido en el mundo por dar las primeras luces sobre la configuración de protones y electrones dentro de la estructura del átomo. Mediante esta propuesta, Thomson sugirió que los átomos eran uniformes y contenían carga positiva de forma homogénea, con incrustaciones aleatorias de electrones dentro de cada átomo.
Para describirlo, Thomson comparó su modelo con el budín de ciruelas. Este símil se empleó posteriormente como un nombre alternativo del modelo. Sin embargo, debido a varias inconsistencias (teóricas y experimentales) sobre la distribución de las cargas eléctricas dentro del átomo, el modelo de Thomson fue descartado en 1911.
MODELO ATÓMICO DE RUTHERFORD
En química, el modelo atómico de Rutherford se refiere a la teoría que muestra cómo se encuentra estructurado internamente un átomo. Dicha teoría fue planteada por el físico Ernest Rutherford en 1911. Para poder probar su teoría, realizó su famoso experimento de la lámina de oro. Gracias a ello, Rutherford es considerado como el creador, tanto de la física nuclear, como la química de átomos.
Antes de que se aceptará como válido el modelo de Rutherford, la comunidad científica, validaba era el modelo atómico planteado por el científico británico Joseph Thomson, el cual afirmaba que solo existían electrones de carga negativa, introducidos en átomos de carga positiva.
las bases que fundamentan la teoría de Rutherford:
-El átomo se encuentra compuesto por dos elementos: un núcleo y una corteza.
-Dentro de la corteza del átomo se pueden observar a los electrones rotando a una velocidad elevada en torno al núcleo.
-El núcleo representa la parte pequeña que se ubica en el medio del átomo que tiene carga positiva.
-El núcleo cuenta con la universalidad de la masa del átomo.
El experimento de Ernest Rutherford consistió en lanzar un flujo de partículas alfa sobre una fina lámina de oro y dependiendo del comportamiento de este flujo de partículas al chocar sobre la lámina de oro, dedujo la siguiente conclusión:
-Los rayos en su mayoría, traspasaban la lámina, esto le llamo la atención, llegando a la conclusión de que el átomo se encuentra absolutamente vacío.
-Solamente una reducida parte de las partículas se desviaban, por lo tanto el núcleo no parecía muy grande.
El modelo de Rutherford desestimó al de Thomson, ya que para Thomson el átomo no se encontraba desglosado por el núcleo y la corteza
-Solamente una reducida parte de las partículas se desviaban, por lo tanto el núcleo no parecía muy grande.
El modelo de Rutherford desestimó al de Thomson, ya que para Thomson el átomo no se encontraba desglosado por el núcleo y la corteza
Comentarios
Publicar un comentario